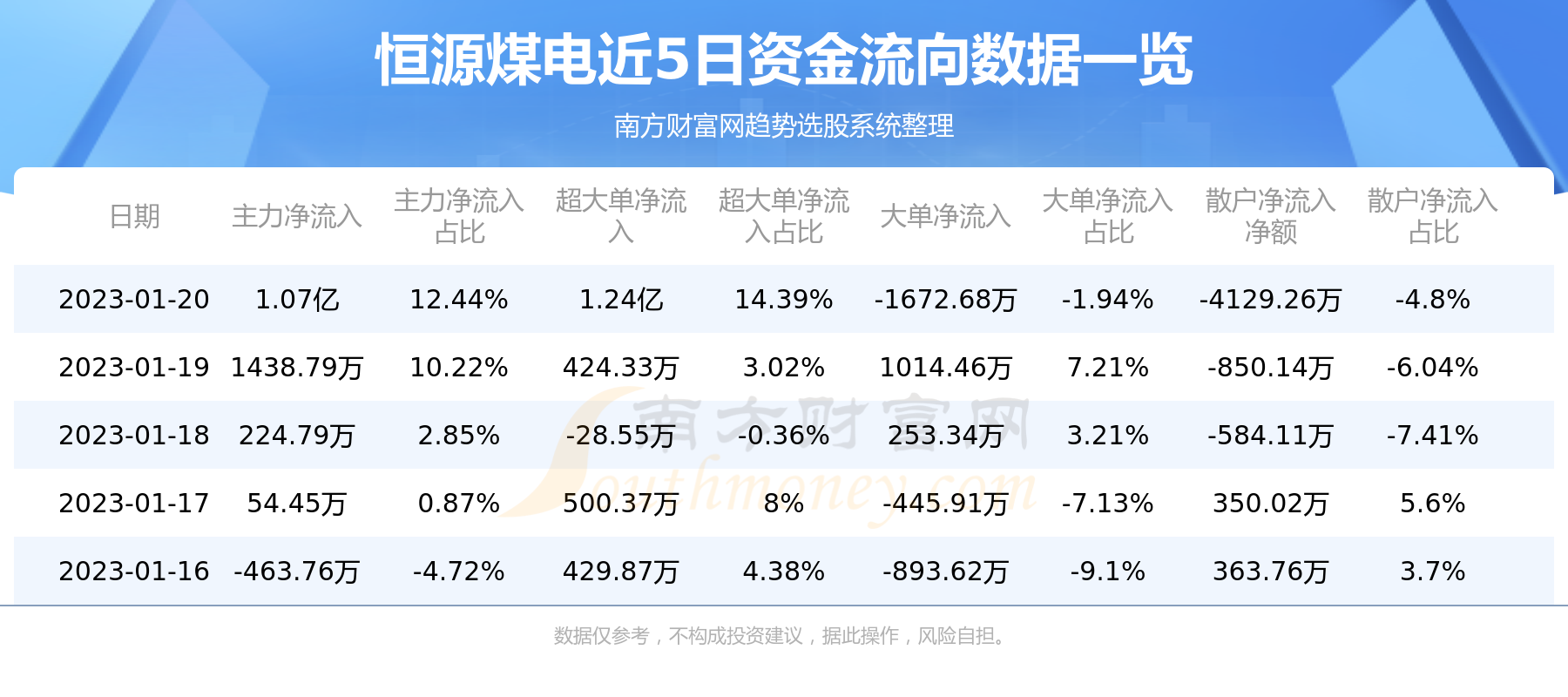
2023年6月4日,由中山大学肿瘤防治中心徐瑞华教授牵头开展的III期JUPITER-02研究在ASCO 2023年会的壁报讨论板块公布了研究最终的总生存期(OS)分析数据(摘要编号:#6009),同时麦海强教授在讨论环节就研究结果做了进一步的交流和分享。
JUPITER-02研究(NCT03581786)是鼻咽癌免疫治疗领域首个国际多中心、随机、双盲、安慰剂对照III期临床研究,旨在评估特瑞普利单抗联合化疗一线治疗复发或转移性鼻咽癌(r/m NPC)的疗效和安全性。此次ASCO大会公布的最终OS结果显示,与安慰剂联合化疗组相比,特瑞普利单抗联合化疗一线治疗r/m NPC可显著延长患者OS(两组中位OS分别为 未达到 vs 33.7个月),死亡风险降低37%(HR=0.63,95% CI:0.45-0.89),P=0.0083。

图:麦海强教授在2023 ASCO年会上分享JUPITER-02研究数据
研究共纳入289例未接受过化疗的r/m NPC患者,随机(1:1)接受特瑞普利单抗240mg (n=146)或安慰剂(n=143)联合吉西他滨和顺铂(GP)化疗(Q3W,最多6周期),随后接受特瑞普利单抗或安慰剂单药治疗(Q3W),直至疾病进展、出现不可耐受毒性或完成2年治疗。分层因素包括入组时的ECOG体能状况评分(0 vs 1)和疾病程度(复发 vs 原发转移)。研究主要终点为独立评审委员会(BIRC)根据RECIST v1.1标准评估的意向性治疗(ITT)人群的PFS,次要终点包括研究者评估的PFS、OS和安全性等。
截至2022年11月18日,中位生存随访时间为36.0个月,结果显示:
与安慰剂联合GP化疗组相比,特瑞普利单抗联合GP化疗可显著延长OS,两组中位OS分别为 尚未达到 vs 33.7个月,死亡风险降低37%,HR=0.63(95% CI:0.45-0.89),P=0.0083。2年OS率和3年OS率分别为78.0% vs 65.1%和64.5% vs 49.2%。
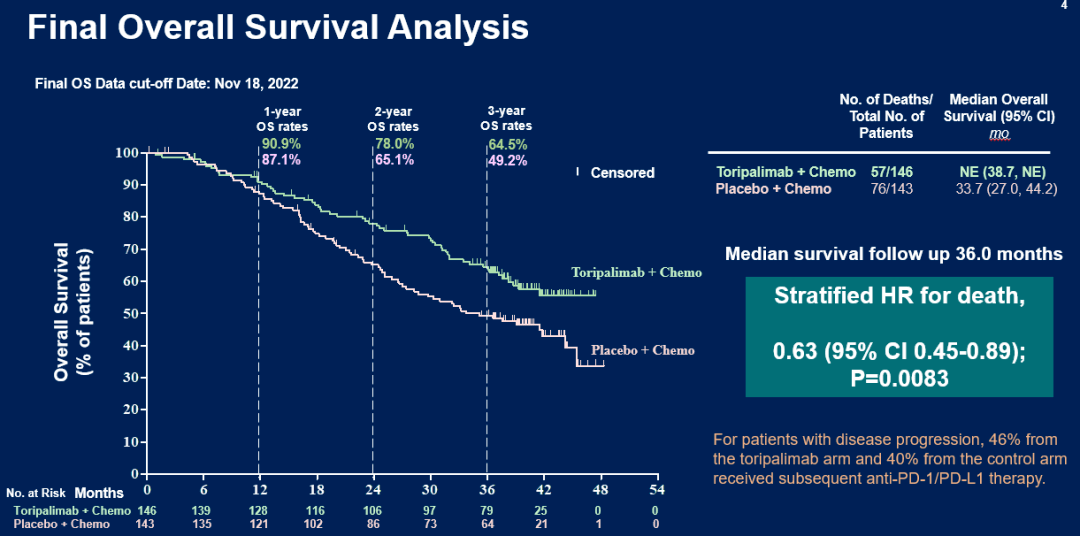
图:ITT人群最终OS分析
关键亚组分析显示,几乎所有亚组均观察到特瑞普利单抗联合化疗组的OS改善。其中PD-L1 表达亚组分析显示,无论 PD-L1 表达状态如何,特瑞普利单抗联合化疗组的OS均得到改善。
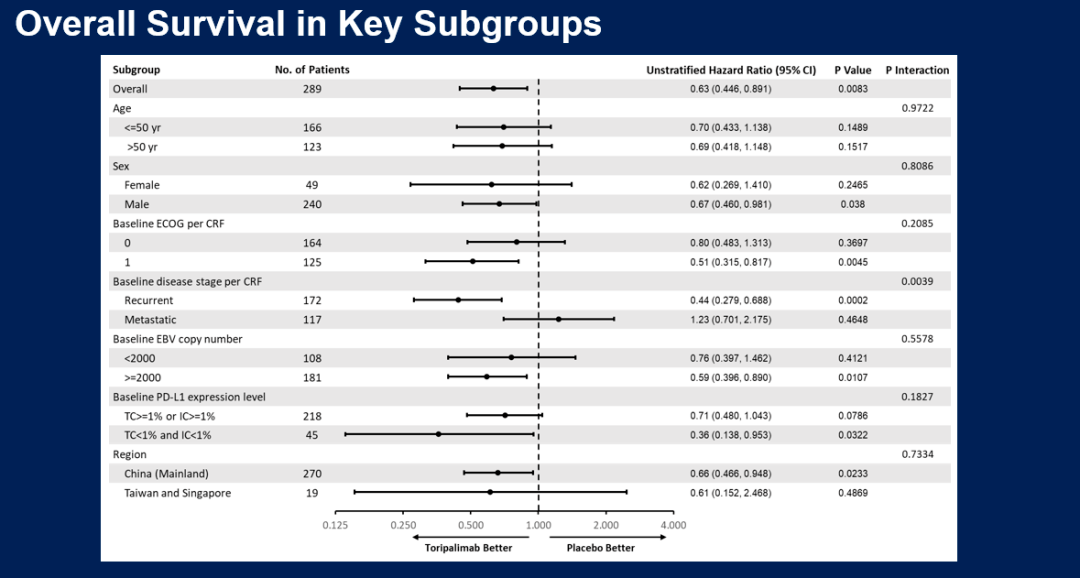
图:关键亚组OS分析
最终PFS分析显示,特瑞普利单抗联合化疗组中位PFS显著长于安慰剂联合化疗组,BIRC评估的两组中位PFS分别为21.4 vs 8.2个月,对比化疗延长13.2个月;疾病进展或死亡风险降低48%(HR=0.52,95% CI:0.37-0.73);名义P < 0.0001。
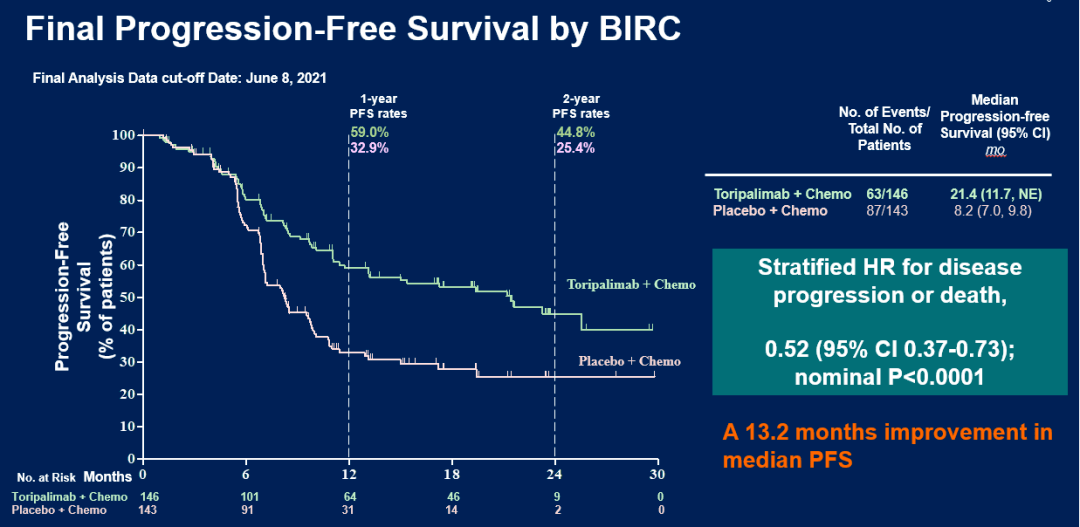
图:ITT人群最终PFS分析
同时,亚组分析显示,包括PD-L1表达亚组在内的关键亚组中均可观察到特瑞普利单抗联合化疗组的PFS改善。
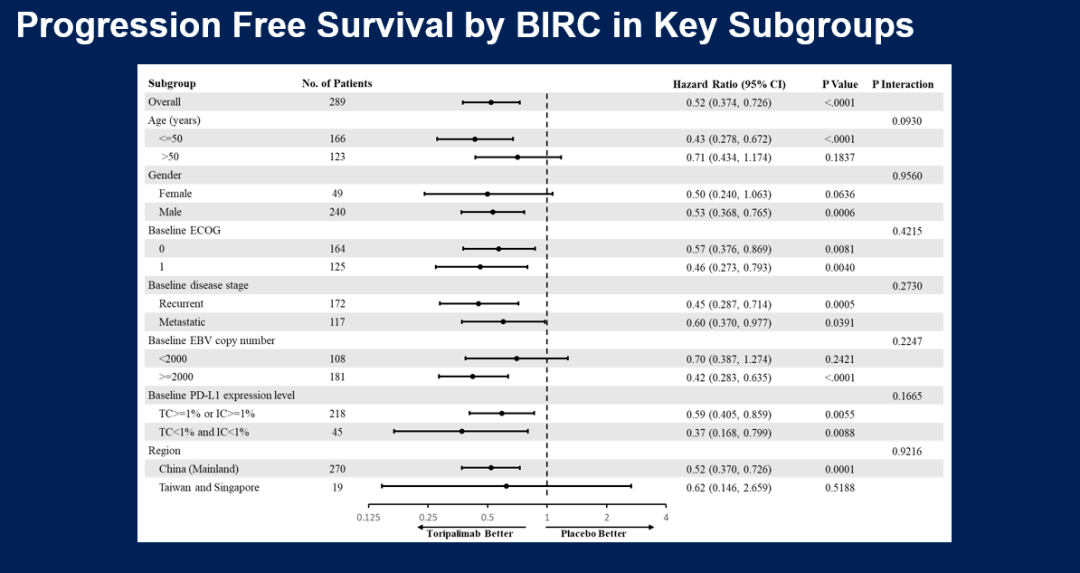
图:关键亚组PFS分析
安全性方面,特瑞普利单抗组未发现新的安全性信号。
综上,与单纯化疗相比,特瑞普利单抗联合GP化疗一线治疗r/m NPC患者可显著延长患者的OS和PFS,且安全性可管理。此结果为全球首个一线鼻咽癌免疫加化疗对比化疗有统计学预设(一类错误控制)并确认生存获益的III期临床试验,为特瑞普利单抗联合化疗成为新的鼻咽癌一线标准治疗提供了确凿证据。
特瑞普利单抗联合吉西他滨和顺铂一线治疗r/m NPC已获得国家药品监督管理局批准,以及中国临床肿瘤学会(CSCO)诊疗指南推荐。该适应症的上市申请正在接受美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)的审评。
内容来源:ASCO官网
关于特瑞普利单抗注射液(拓益?)
特瑞普利单抗注射液(拓益?)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
截至目前,特瑞普利单抗已在中国获批6项适应症:用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有3项适应症纳入《2022年药品目录》,是国家医保目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。
在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
目前,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请(BLA)正在接受FDA审评。2022年12月和2023年2月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。